En chimie, la matière désigne l’ensemble des objets et des composés naturels ou synthétiques qui constituent notre univers. Au fil des siècles, les progrès techniques, tels que l’utilisation de microscopes de plus en plus perfectionnés, ont permis aux scientifiques d’observer l’infiniment petit et de percer quelques-uns des secrets de la matière.
Qu'est-ce qu'un atome ?
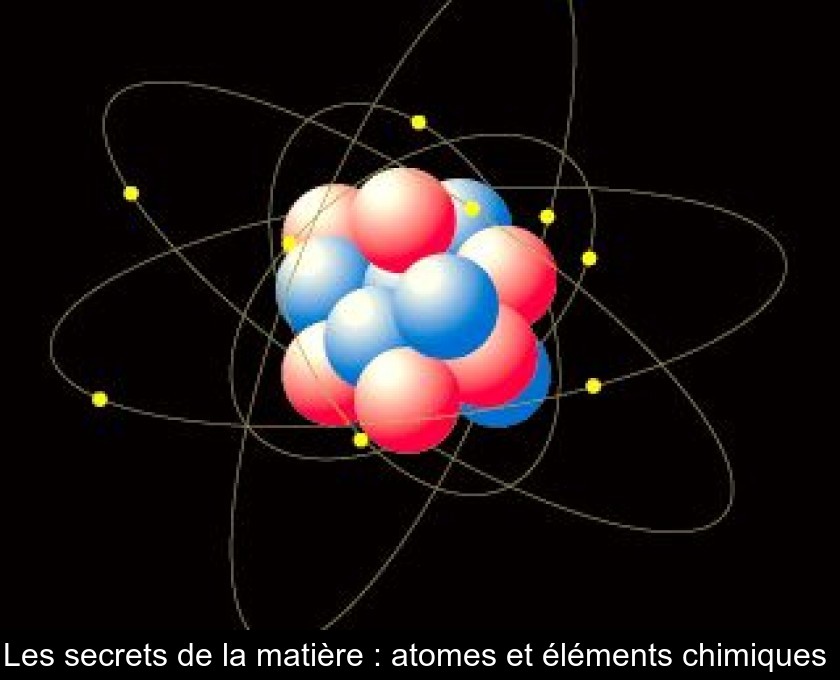
L’atome, dont la taille est de l'ordre du dixième de nanomètre, est le constituant élémentaire de la matière. Son nom vient du grec ancien atomos signifiant "que l'on ne peut pas diviser".
Pendant des siècles, les atomes ont en effet été considérés comme des "grains" de matière indivisibles. Mais, depuis le début du XXème siècle, des expériences de physique nucléaire ont mis en évidence l’existence des constituants de l'atome : les particules élémentaires.
A noter : la théorie atomistique de l’Univers, c’est-à-dire la théorie selon laquelle la matière se compose d’atomes, date de l’Antiquité et a été développée pour la Première fois par le philosophe grec Démocrite.
La structure de l’atome
Un atome est généralement constitué d'un noyau chargé positivement et dans lequel est concentrée toute sa masse autour duquel gravitent des électrons chargés négativement.
Le noyau des atomes est composé de particules appelées "nucléons" : les protons, qui sont chargés positivement, et les neutrons, qui sont électriquement neutres.
Ainsi, toute matière, qu’elle soit vivante ou inerte, est formée à partir de trois types de particules : les protons, les neutrons et les électrons.
Par exemple, un atome d’hydrogène est le plus simple et le plus léger de tous : il possède uniquement un électron et un proton.
Les molécules
Les atomes ont tendance à s’associer pour donner naissance à des molécules plus complexes telles que l’oxygène O2, l’eau H2O, le sel de table (ou chlorure de sodium) NaCl ou l’ammoniac NH3.
Pour former ces molécules, les atomes se lient entre eux en mettant en commun certains des électrons présents sur leur couche externe (aussi appelée "couche périphérique" ou "couche de valence") au cours d'une réaction chimique.
A noter : certains atomes ne réagissent presque pas avec les autres. Il s’agit de gaz rares comme l’hélium He, l’argon Ar, le néon Ne, le krypton Kr et le xénon Xe. Ils sont dits "chimiquement inertes".
Les éléments chimiques
Notre univers se compose de plus d’une centaine d’éléments chimiques existant sous différentes formes : atomes, ions, molécules...
Un élément chimique désigne l'ensemble des atomes qui possèdent le même nombre de protons dans leur noyau. Ce nombre, appelé numéro atomique de l'élément est noté Z.
Les éléments chimiques sont répertoriés dans le tableau périodique de Mendeleïev, du nom du chimiste russe qui a inventé cette classification par ordre croissant de masse atomique.
Chaque élément chimique est représenté par un symbole qui permet de l’identifier.
Il s’agit par exemple du Carbone (C), de l’Or (Au), de l’Argent (Ag), du Cuivre (Cu) ou du Soufre (S).
A noter : deux atomes ayant le même numéro atomique Z mais des nombres de neutrons différents sont appelés isotopes.
Beaucoup d’éléments chimiques possèdent des isotopes et leur noyau est souvent instable. Ils se désintègrent en donnant un autre noyau ou en émettant un rayonnement, jusqu'à atteindre un équilibre : c’est ce que l’on appelle la radioactivité.
Plus d'information :
Tag : matière, secrets de la matière, structure de la matière, atome, atomes, molécules, éléments chimiques, particules élémentaires , atomes, atome, noyau, éléments chimiques, molécules, Univers, neutrons, protons, particules, isotopes, élément chimique, numéro atomique, gaz rares, périphérique, KR, Krypton, couche de valence, réaction chimique, Argon, Helium, néon, xénon, Rayonnement, radioactivité, soufre, cu, cuivre, masse atomique, russe, chimiste, Mendeleïev, tableau périodique, ions, NH3, ammoniac, NaCl, philosophe, Antiquité, théorie atomistique, Particules élémentaires, physique nucléaire, indivisibles, grec ancien, nanomètre, infiniment petit, microscopes, grec, Démocrite, masse, chlorure de sodium,